AUTOIMMUN MÁJBETEGSÉGEK (AILD)
Ritka Májbetegségek Európai Referenciahálózat (ERN RARE LIVER) nemzetközi kollaborációs munkái
Az Európai Unio (EU) 2017-ben létrehozta az úgynevezett Európai Referenciahálózatokat (ERN), melyhez a Ritka Májbetegségek Európai Referenciahálózatát is (ERN RARE LIVER) tartozik. A hálózat koordinátora a Hamburgi Egyetem (University Medical Centre Hamburg-Eppendorf) és Prof. Dr. Ansgar Lohse. A Gasztroenterológiai Tanszék 2019 márciusában társult tagként csatlakozott az ERN RARE LIVER programhoz (24) és többlépcsős pályázatot, valamint auditot követően 2022. januártól teljes jogú tagságot nyert el. A munkacsoport a hálózat prospektív multicentrikus regiszterében (R-Liver Registry) 2019 óta dolgozik aktívan, ahová a különféle autoimmun májbetegséggel (AILD) felismert és gondozott betegek adatai kerülnek strukturált módon (UNIDEB, n=148, autoimmun hepatitis, AIH: 33, primer biliáris kolangitisz, PBC: 59, primér szklerotizáló kolangitisz, PSC: 40 és átfedő szindróma: 16). Az egész Európára kiterjedő betegnyilvántartás lehetővé teszi a nagy mennyiségű, prospektív adatgyűjtést, az alkalmazott diagnosztikai technológiák regionális eltéréseinek felmérését és a jövőben ezek egységesítését, valamint a klinikai irányelvekben meghatározott minőségi célok teljesülésének ellenőrzését, a hiányosságok felszámolását, és ezáltal a betegellátás minőségének javulását. Ezzel követni tudják a természetes kórlefolyást, a kezelés hatékonyságát, és a hosszú távú előnyöket és károkat. A munkacsoport az AILD kapcsolatos különböző kutatási programokba is bekapcsolódott: az AIH európai helyzetének és a gyógyszeres kezelés hatékonyságnak felmérése (1), az AILD élő beteg életminőségének jellemzése (2) és javítása (3). A munkacsoport aktív az egyéb regiszterekben is, mint vaszkuláris és cisztás májbetegség regiszterek, valamint a SARS-CoV-2-fertőzés AILD regiszter. Három független nemzetközi regiszter adatainak bevonásával megállapították, hogy az AIH-ban alkalmazott immunszuppresszív kezelés ellenére egyidejű SARS-CoV-2-fertőzés esetén nem volt gyakoribb a kedvezőtlen kimeneteli események bekövetkezésének kockázata a krónikus májbetegség más formáiban szenvedő betegekhez és a nem májbetegekhez képest (25).
Az autoimmun hepatitisz európai helyzete és az alkalmazott gyógyszeres kezelés hatékonysága
Autoimmun hepatitisben a kezelés célja a májbetegség progressziójának megakadályozása (dekompenzált májcirrózis kialakulása) és májátültetés szükségességének elkerülhetősége. Az AIH elsővonalbeli kezelésében a szteroidokat alkalmazzuk remisszió indukcióra, míg az azathioprint (AZA) a remisszió fenntartására. Az optimális dózisok és a kezelési séma tekintetében azonban továbbra is vannak kérdéses pontok (remisszió indukcióra alkalmazott prednisolondózis, mono- [AZA] vagy alacsonyabb dózisú, de kombinált [AZA+prednisolon] fenntartó terápia). Hepatológiai Munkacsoportunk 2017-ben csatlakozott Prof. Dr. Joost PH Drenth és a hollandiai Radboud Egyetem által koordinált multicentrikus, retrospektív vizsgálathoz, melynek célja a AIH gyógyszeres kezelésének jelenleg kérdéses pontjainak megválaszolása. A tanulmány rávilágított többek között arra is, hogy a remisszió indukció céljából alkalmazott prednisolon alacsonyabb dózisban alkalmazva (0,5 mg/kg/nap) ugyanolyan hatékony, ugyanakkor kevesebb mellékhatással jár, mint a magasabb dózisok alkalmazása (1 mg/kg/nap). (26) Az elsővonalbeli kezelés megkezdését követően a terápiás válasz hatékonyságának lemérése elengedhetetlenül fontos, hiszen ez határozza meg, hogy szükséges-e annak módosítása. A betegek általában 6-12 hónap alatt érik el a teljes biokémiai remissziót, mely függ a betegségsúlyosságtól és az egyidejűleg fennálló társbetegségektől. A vizsgálat során igazolásra került, hogy azok a betegek, akik gyorsan reagálnak az indukciós kezelésre, azaz a GOT a kezelés 8. hetére jelentősen lecsökkent, 6-12 hónap alatt teljes biokémiai remisszióba kerülnek, emellett a májbetegséggel kapcsolatos halálozás és májtranszplantáció kockázata is kisebb volt. (27) Az AZA fenntartó kezelés indításának optimális időpontját illetően is megoszlanak a vélemények, mely a szakmai ajánlásokban is tükröződik. 12 európai centrum bevonásával 900 AIH beteget vizsgálva nem volt különbség a korai (2 héten belül) és késői (2 héten túl) indítású AZA kezelés esetén a terápiás választ és az AZA elhagyásának szükségességét illetően, melyre a betegek 15%-ban volt szükség. A leggyakoribb oka a gyógyszerváltásnak az AZA intolerancia volt. (28, 29)
Az AIH jelenlegi európai helyzetére vonatkozó első adatok is elérhetőek már. Az R-Liver Regiszter adatainak interim analízise rávilágított, hogy az AIH kezelése igen heterogén, még kiemelt szakértői centrumok esetén is. Az első 6 hónapban igen gyakori volt a betegek körében a gyógyszerintolerancia, mely miatt a betegek 30,4%-ban volt szükség a terápia módosítására. Emellett a regiszter felhívta a figyelmet arra is, hogy a 12 hónapos kezelést követően a betegek közel egyharmadában nem normalizálódtak a transzamináz értékek és kevesebb mint egyharmaduknál lehetett csak a szteroid kezelést leépíteni. Az interim analízis eredményeit az EASL 2023-as Kongresszusán kerül bemutatásra. (30)
A hepatocellulárs carcinoma (HCC) lokális és szisztémás kezelésének tolerálhatóságára és prognózisára vonatkozó adatok HCC-AILD-ben kevéssé ismertek. 1996 és 2020 között 13 hepatológiai centrumban összesen 107 HCC-AILD beteg (AIH, n=55 és PBC, n=52) kezelésére került sor. A túlélés vonatkozásában a nem-AILD-hez társuló HCC-vel összevetve (propensity score párosítást végezve 1:1 arányban 347 nem-AILD-hez társuló hamburgi HCC-beteggel) nem volt különség sem a lokális (transzarteriális kemoembolizációval [TACE]), sem pedig a szisztémás tirozinkináz-gátlókkal (TKI) végzett kezelés esetén. Ugyanakkor a kezelések tolerálhatósága kedvezőbbnek mutatkozott a AILD- HCC esetén. Mivel a HCC-AILD betegek az immunterápiás vizsgálatokból kizárásra kerültek, a TKI-kkel történő szisztémás kezelés továbbra is a HCC-AILD kezelés standardja marad. (31)
Az autoimmun májbetegséggel (AILD) élők életminőségének jellemzése
Az egészséggel kapcsolatos életminőség (HRQoL, health related quality of life) és a gyógyszerszedési szokások (adherencia) vizsgálata eddig nem kapott különösebb klinikai vagy tudományos figyelmet AILD-ben szenvedő betegek gondozása során. A mindennapi klinikai tapasztalatok azonban egyértelműen azt mutatják, hogy az AILD-ben szenvedő egyének súlyos tünetekkel küzdenek, melyek jelentősen kihatnak az általános közérzetükre, mely különösen gyakori AIH-ban. Ezek lehetnek hangulatzavarok, depresszió, szorongás, kognitív diszfunkciók, krónikus fáradtság és csökkent fizikai aktivitás. Feltételezhető bizonyos gyógyszerek életminőségre gyakorolt negatív hatása is. Az AILD kezelése szempontjából kritikus jelentőséggel bír az életminőséget befolyásoló tényezők, a következetes gyógyszerszedés és a klinikai jellemzők közötti kapcsolat pontosabb jellemzése. (32, 33) Kilenc európai centrum részvételével egy multicentrikus, keresztmetszeti, kérdőív alapú tudományos vizsgálathoz csatlakoztunk, melyet szintént a Radboudumc Egyetemi Klinika, Gasztroenterológiai és Hepatológiai Tanszék vezet (Dr. Tom Gevers, Nijmegen, Hollandia). A vizsgálatban az AIH betegek (n=748, ebből UNIDEB n=69) életminőségét és a gyógyszerszedéssel kapcsolatos szokásai kerülnek felmérésre validált életminőség kérdőívek segítségével (SF-36, SF-12, EQ5D-5L, GAD-7, PHQ-9, MFIS, SSS-8, SSD-12, BMQ Specifikus Kérdőív, VAS adherencia skála, MLQ, PBC-40, PBC-27, PSC-PRO, 5-D és VAS viszketési skála). Egy altanulmány keretén belül PHQ-9 ≥15 pontszám esetén komplex kivizsgálás történik pszichiáter szakorvos bevonásával depresszió irányába. A vizsgálat interim analízise bizonyította, hogy az AIH kezelése során a komplett biokémiai remisszió (CBR) elérése összefüggést mutatot a jobb életminőséggel. Az interim analízis eredményei az EASL 2023-as Kongresszusán kerülnek bemutatásra. (34) Az AIH betegek életminőség vizsgálatával párhuzamosan a nem AIH AILD betegek felmérése is megtörtént (Prof. Dr. Christoph Schramm, University Medical Centre Hamburg-Eppendorf), 680 beteg, ebből 131 UNIDEB, a kiértékelés még folyamatban van.
Pszichoszociális támogatás az autoimmun májbetegséggel (AILD) élők számára
A pszichoszociális támogatás a ritka betegségekkel élő betegek ellátásának kulcsfontosságú eleme, mégis a mai napig nem került előtérbe. Az AILD szenvedők életminőségének javítása a célja annak a tudományos hároméves vizsgálatnak, amely „Ritka Betegségek Európai Közös Programjai (European Joint Programmes on Rare Diseases [EJP ED] keretében nemzetközi konzorciumi pályázatban valósul meg (Konzorcium Koordinátor: Hamburg-Eppendorf Egyetemi Egészségügyi Központ, Németország; Résztvevő centrumok: Torontói Egyetem, Egyetemi Egészségügyi Hálózat, Kanada; Ghent-i Egyetemi Kórház, Belgium; Varsói Egyetem, Lengyelország; Debreceni Egyetem, Magyarország). A vizsgálatban résztvevők segítséget kapnak a krónikus betegség okozta lelki problémák feldolgozásában, a depresszió és a szorongás kialakulásának elkerülésében, sorstár segítőkön keresztül. (35)
Autoimmun MájBEtegségek Regiszter: AMBER-HU
Autoimmun májbetegségek epidemiológiájának vizsgálata magyar betegpopulációban
A közép-kelet európai régióból az AILD epidemiológiájával kapcsolatosan limitáltan állnak adatok rendelkezésre. Az AMBER-HU Regiszter révén az AILD betegségek epidemiológiájára, lefolyására, az alkalmazott gyógyszeres kezelés hatékonyságára, a gyógyszerek okozta mellékhatások előfordulására és az extrahepatikus szövődmények (mint pl. csontanyagcsere zavar) előfordulási gyakoriságára hazai adatokat fog szolgáltatni, A regiszter jövőbeni eredményeinek kiemelt jelentősége lehet a betegek hosszú távú gondozása, a szövődmények megelőzése, illetve kezelése szempontjából. Továbbá lehetőség lesz a nyugat-európai és észak-amerikai régióban működtetett regiszterek (International Autoimmune Hepatitis Group – IAIHG, Dutch Autoimmune Hepatitis Working Party in Nijmegen, International PSC study group – IPSCSG,The Global PBC Study Group) adataival összehasonlításokat végezniükk.
Az azathioprin metabolitszint meghatározás jelentősége az AIH kezelésének egyénre szabott vezetésében
AHamburgi Egyetemmel (Kollaboráció: Prof. Dr. Christoph Schramm, University Medical Centre Hamburg-Eppendorf) és a Debreceni Egyetem Proteomika Szolgáltató Laboratóriummal (Biokémiai és Molekuláris Biológiai Intézet, Prof. Dr. Csősz Éva, Guba Andrea) együttműködve a munkacsoport elkezdt a tiopurin gyógyszer-metabolitszintek mérésének beállítását in-house folyadékkromatográfiás tandem tömegspektrometriás (LC MS/MS) módszerrel. A vizsgálat fő célja a tiopurin-metabolitszintek alkalmazhatóságának értékelése az AIH kezelésének klinikai gyakorlata során Az AIH remisszióban tartásának kulcsszerepelője az AZA. A tiopurin metabolizmus egyes pontjaiban ismertek egyéni variációk, melynek következtében az aktív metabolitok szintje jelentős egyének közötti eltéréseket mutathat. A kezelés hatékonysága, illetve a gyógyszermellékhatások megjelenése összefüggést mutat az AZA metabolitszintekkel, melyek meghatározása lehetővé teszi a terápia adott egyénre szabott vezetését.
Az immunszerológiai vizsgálat módszertanának újraértékelése autoimmun hepatitisben
Az AIH diagnózisa betegségspecifikus markerek hiányában komplex módon, különféle klinikai, biokémiai, immunszerológiai és hisztológiai jellegzetességek együttese alapján és egyéb májbetegség fennállásának kizárásával történik. Érthető módon így a kórisme felállításának egyik alappillére a laboratóriumi diagnosztika. Az EUROIMMUN Medizinische Labordiagnostika (Dr. Silvia Jacobsen, Tanja Seifert) német laboratóriummal és a Debreceni Egyetem Laboratóriumi Medicina Intézettel (Prof. Dr. Antal-Szalmás Péter) való kollaboráció vizsgálják az antinukleáris antitestek (ANA) rágcsálószöveten (LKS szubsztrát, liver-kideny-stomach) indirekt immunfluoreszcens technikával (IIFT) történő kimutatásának helyettesíthetőségét humán epitelioma (HEp)-2 sejteken történő IIFT-vel és/ vagy ANA ELISA-val
Bél-máj tengely interakciójának vizsgálata a szövődményes és progresszív betegségforma kialakulásában primér szklerotizáló kolangitis
Primér szklerotizáló kolangitiszben (PSC) a progresszív epeúti gyulladás következtében fibrózis alakul ki és a betegek jelentős részénél idővel májtranszplantáció válik szükségessé a végstádiumú májbetegség és annak szövődményei miatt. A PSC gyakran szövődik gyulladásos bélbetegséggel (IBD). Továbbá bizonyos malignus daganatok kialakulásának kockázata is jelentősen megnő (mint pl. kolangiokarcinóma, kolorektális karcinóma). Nem került azonosításra ezidáig olyan szerológia marker, mely betegségspecifikus lenne és így segítené az egyébként nehéz diagnosztikát. Nincs a betegségaktivitást, illetőleg a progresszív betegséglefolyást vagy malignus daganatok kialakulását hatékonyan előrejelző szerológiai marker sem. A pontos kockázatbecslés, a betegség stratifikáció és az utánkövetési stratégia éppen ezért PSC-ben szintén nem megoldottak. A biliáris traktus és a bél párbeszédét jellemző biomarkerek kutatásával PSC-ben a klinikailag releváns alcsoportok kijelölésén túl a patogenezis szempontjából jelentős összefüggések feltárására is lehetőség nyílik, ami új kezelési módok felfedezését segítheti elő. (36-38) Primér szklerotizáló kolangitiszben nincs ugyanis olyan elérhető gyógyszeres terápia, mely kuratív lenne, vagy akárcsak képes lenne lassítani/ megakadályozni a betegség progresszióját.
A bél-máj tengely interakciójának az AILD betegség progresszióra gyakorolt hatását primer szklerotizáló kolangitiszben (PSC) vizsgálva elsőként igazoltuk, hogy a bél veleszületett immunrendszeréhez tartozó glikoprotein 2 (GP2) és a citoszkeletális filamentózus (F) aktin fehérjék ellen fokozott IgA izotípusú antitestképződés észlelhető, melyek a progresszív betegséglefolyás új szerológia kockázati tényezői. Az antitestek képződésének mechanizmusai a kórkép patogenezisében kulcsfontosságú bél-máj kölcsönhatás újabb aspektusait tárják fel. A GP2-vel szemben kialakuló fokozott IgA válasz PSC-re nézve specifikusabb. Egyrészt a krónikus májbetegségek differenciál diagnosztikájában a betegség specifikus markerének tartható. Másrészt a fimbriális-adhezin H (FimH)-val rendelkező bélbaktériumok fokozott, GP2-mediálta mukozális retrográd transzportjának lehetséges szerepét veti fel a fibrogenezisben, mely a TLR4 jelátviteli útvonal aktiválásán keresztül valósul meg (3. ábra). Az F-aktinnal szemben kialakuló fokozott IgA termelődés ugyanakkor a szervezet részéről sokkal inkább egyetemesebb válaszreakciónak tartható, mely nagy valószínűség szerint felfokozott veszély-kapcsolt molekuláris mintázat (DAMP) jelenlétére utal, melyben fontos szerepe van a bélbarrier károsodásnak és a béltraktus felől fokozottan érkező kórokozó-asszociált molekuláris mintázatnak (PAMP). (39-41)
3. ábra A pankreász glikoprotein 2 feltételezett szerepe a primer szklerotizáló kolangitisz autoimmun-vezérelt fibro- és tumorigenezisében.
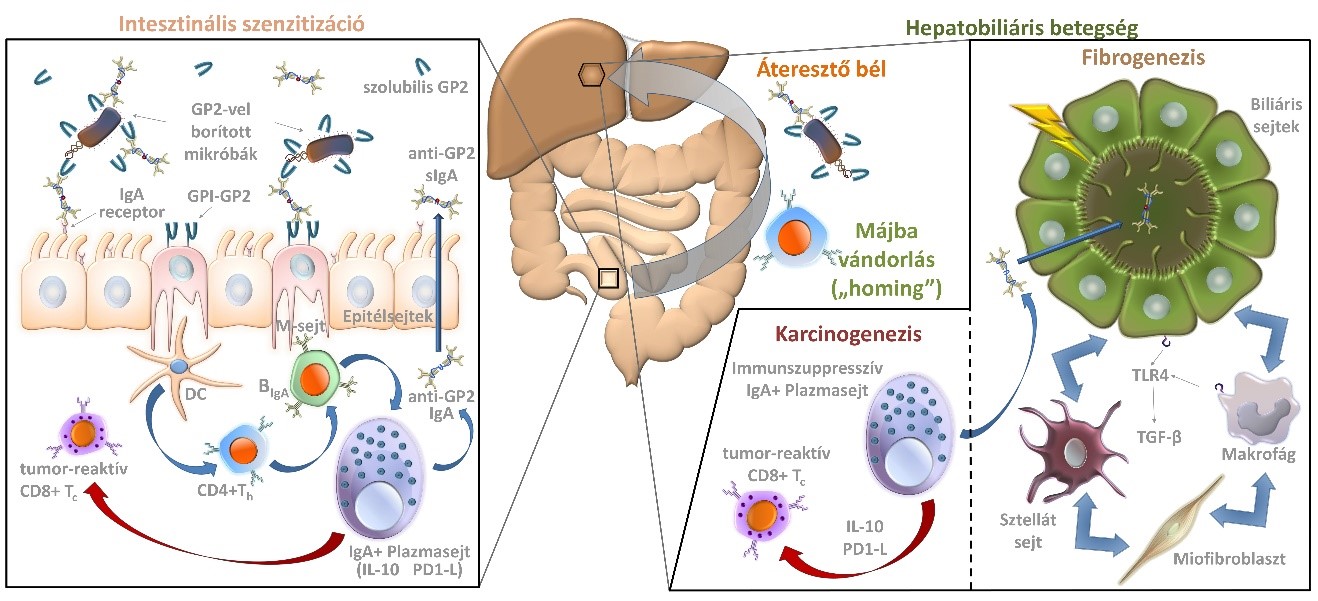
Az emésztőenzimekkel együtt a glikoprotein 2 (GP2) a hasnyálmirigy acinus sejtjeiből szekretálódik a bél lumenébe. Ezen kívül a GP2 a mikrofold sejtek (M-sejtek) (melyek a Peyer-foltokban helyezkednek el) luminális felszínén is expresszálódik (glikozil-foszfatidil-inozitol [GPI] által lehorgonyzott). A molekula mindkét formája kölcsönhatásba lép a FimH+ baktériumokkal és opsonizálja őket. A lehorgonyzott forma részt vehet a kötött ligandumok (FimH+ mikrobák) transzcitózisában az M-sejteken keresztül, amelyek továbbítják azokat a nyálkahártyához kapcsolódó immunrendszerben található antigénprezentáló sejtekhez, például a dendritikus sejtekhez (DC). A mikrobához kötött GP2 epitópok a CD4-pozitív T-helper sejtek (CD4+ Th) számára a bakteriális antigénekkel együtt kerülnek bemutatásra, ami a GP2-vel szembeni tolerancia elvesztéséhez vezet. Klonális expanzió után ezek a szenzibilizált sejtek "hazatérhetnek" mind a bélbe, mind a májba, ahol beindítják (kék nyilak) az IgA+ B sejtek IgA+ plazmasejtekké történő differenciálódását. A termelt anti-GP2 IgA-t a hámsejtek aktívan szállítják a bél- és epeúti lumenekbe szekretoros IgA (sIgA) formájában, ahol a GP2-hez kötődik. A hámsejtek luminális felszínükön IgA-receptorokat fejeznek ki, amelyek részt vesznek az sIgA molekulák aktív retrográd transzportjában (jellemzően antigénekkel összekapcsolva). Ez a folyamat hozzájárulhat a bélnyálkahártya bakteriális túlterheléséhez, megemelve a baktériumkomponensek szintjét a keringésben. A máj- és epeutakban a bakteriális komponensek a Toll-like receptor 4 (TLR4) - transzformáló növekedési faktor-β (TGF-β) útvonalat indítják be, elősegítve a fibrosis és a cirrózis kialakulását. Eközben a folyamatos gyulladásra adott válaszként az IgA+ plazmasejtek egy sora immunszuppresszor fenotípust alakít ki, amely interleukin-10-et (IL-10) és programozott sejthalál 1 ligandumot (PD1-L) expresszálnak. Ezek a molekulák gátolják (piros nyíl) a tumorszuppresszív citotoxikus CD8+ T-sejteket (CD8+ Tc), elősegítve a tumor kialakulását a hepatobiliáris- és a bélrendszerben.
24. Balogh Boglárka IT, Pfliegler György, Gustav Buescher, Papp Mária. Ritka Májbetegségek Európai Referenciahálózata (ERN RARE-LIVER): a betegellátást segítő Klinikai Betegadat Kezelő Rendszer (Clinical Patient Management System, CPMS). Central European Journal of Gastroenterology and Hepatology. 2020;6(1):10-7.
29. Papp M. Autoimmun hepatitis - A nehezen kezelhető beteg. Medical Tribune -.7 (2022), p. 22-24. -.
30. Schregel I, Papp M, Sipeki N, Kovats P, Taubert R, Engel B, et al. Results of the prospective multicentre European R-LIVER Registry reveal the unmet clinical needs of autoimmune hepatitis. EASL ILC; Vienna2023, Abstract Under Revision.
31. Stern L, Schmidt C, Walter A, Drenth JPH, Nevens F, Papp M, et al. Transarterial chemoembolization and systemic treatment in patients with autoimmune liver disease-associated hepatocellular carcinoma: Outcome and safety profile. EASL ILC; Vienna2023, Abstract Under Revision.
34. Snijders R, Janik MK, Mund M, Koc Ö, Papp M, Grønbæk L, et al. The impact of complete biochemical response on health-related quality of life in patients with autoimmune hepatitis: a multicentre prospective cross-sectional study. EASL ILC; Vienna2023, Abstract Under Revision.
A sikeresen zárult Q.RARE.LI program záróközleménye az alábbi egyetemi oldalon tekinthető meg: